第一作者简介 雷川,男,1988年生,中国科学院地质与地球物理研究所兰州油气资源研究中心硕士研究生。E-mail:leichuan1988@163.com。
通讯作者简介 李红,西北大学地质学系讲师,主要从事沉积学和储集层地质学的教学和研究工作。E-mail:lihong2008@nwu.edu.cn。
新疆乌鲁木齐地区红雁池南剖面中二叠统芦草沟组主要发育浅湖至半深湖背景下的中、薄层深灰色白云岩、灰岩、粉砂岩与中、厚层灰黑色页岩、泥岩互层。白云岩主要由泥晶白云石、铁白云石及少量方解石、高镁方解石组成,富含有机质。白云石粒径约 3~10, μm,阴极发光呈现均匀昏暗的砖红色。白云石主要有微球状(直径约 5~8, μm)、微簇状(长度约 2, μm)及他形( 1~10, μm)等 3种微形貌。微球状白云石具有显微纹层结构,似为生长纹层,放大至 6万倍发现显微纹层是由无数纳米级颗粒构成。他形白云石放大至 4万倍发现主要由大量直径约 0.25, μm的球状微粒聚集粘结而成,具有微生物矿化的特征。将研究区白云石与现代典型微生物成因白云石相比,其显微形态特征非常相似。研究区白云岩
About the first author Lei Chuan,born in 1988,is a master candidate of Lanzhou Center for Oil and Gas Resources,Institute of Geology and Geophysics,Chinese Academy of Sciences.E-mail: leichuan1988@163.com.
About the corresponding author Li Hong,working at Department of Geology,Northwest University,is mainly engaged in sedimentology and reservoir geology.E-mail: lihong2008@nwu.edu.cn.
The dark-gray,middle to thin-bedded dolostone,limestone,siltstone,and gray or black shale and mudstone,deposited in shallow to open lake settings, are mainly developed in the Middle Permian Lucaogou Formation in southern Hongyanchi section of Ürümqi in Xinjiang. Dolostone which is rich in organic matter is mainly composed of dolomite and ankerite with small amount of calcite and Mg-calcite.The dolomite ranges from 3 to 10,μm in crystal sizes and shows homogeneously dark-red luminescence.Micromorphologies of the dolomite vary from microspherules(5~8,μm in diameter),clusters(about 2,μm long),to anhedral dolomite under the SEM.Microspherules have microlaminae structure called “growth coating” which consists of numerous nanoscale particles in the 60000 times enlarged SEM photomicrographs.Anhedral dolomite which is mainly composed of massive particles(about 0.25,μm)in 40000 times enlarged SEM photomicrographs shows the features of microbial mineralization.The above morphologies of dolomite are highly similar to the typical modern microbial dolomite in experiment-culture and natural environments.The
白云岩的成因是沉积学领域的难点问题之一。近年来的研究表明, 在实验室和自然条件下, 厌氧微生物(主要包括硫酸盐还原菌和产甲烷古菌)(Compton, 1988; Vasconcelos et al., 1995; Vasconcelos and McKenzie, 1997; Boetius et al., 2000; Warthmann et al., 2000; Kenward et al., 2009)和需氧嗜盐微生物(Sánchez-Román et al., 2008, 2009a)的代谢活动均有助于克服白云石低温沉淀的动力学障碍, 促进白云石沉淀, 并被称之为“ 微生物白云石模式” (the microbial dolomite model)。目前, 微生物白云石模式在解释一些现代自然条件下形成的白云石的成因方面已获得较广泛的认可(Vasconcelos et al., 1995; Vasconcelos and McKenzie, 1997; García del Cura et al., 2001; Warthmann et al., 2005; Wacey, 2007; 于炳松等, 2007; Deng et al., 2010), 然而, 这种模式能否用于解释地质历史时期发育的大规模的白云岩成因却仍存在较大争议(Fernández-Diaz et al., 2006; Sánchez-Román et al., 2009a)。特殊的显微形貌(如球状或哑铃状等)及稳定同位素特征等是识别是否有微生物参与白云石沉淀的重要标志, 而白云石的特殊微形貌却恰恰是争议的焦点, 因为有研究者在无机条件下借助于硅质凝胶或其他离子添加剂也合成了具有球状及哑铃状外貌的碳酸盐(Tracy et al., 1998a, 1998b; Fernández-Diaz et al., 2006)。故对于微生物参与白云石沉淀的机理, 仍需在显微形态学、地球化学及古代实例研究方面进行更深入的探索。古代微生物白云石, 尤其是湖相微生物白云石的实例研究, 属于白云岩问题的薄弱领域, 因此, 文中拟以新疆乌鲁木齐地区中二叠统芦草沟组湖相泥晶白云岩为研究对象, 从白云石的显微形态、显微结构和稳定同位素等方面探讨其成因机理, 以期为该地区晚古生代可能存在的微生物白云石的研究提供实例。
研究区位于新疆维吾尔自治区乌鲁木齐市红雁池水库东南方向(图1-A), 所测剖面沿公路展布约0.4, km(图1-B), 总体走向23° , 地层出露良好(图 1-C)。
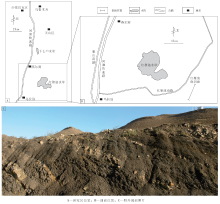 | 图1 新疆乌鲁木齐地区红雁池南剖面地理位置及剖面照片Fig.1 Location and outcrop photo of southern Hongyanchi section in Ü rü mqi, Xinjiang |
该地区中二叠统自下而上依次包括乌拉泊组、井井子沟组、芦草沟组及红雁池组。研究剖面中出露地层包括井井子沟组和芦草沟组, 二者呈整合接触。芦草沟组以一层厚约3.4, m的砂砾岩与井井子沟组区分, 其砾石的分选性、磨圆度较好, 粒度由底部向上部逐渐减小, 并变为含砾砂岩。芦草沟组主要由砂砾岩、砂岩、泥岩、页岩、油页岩、鲕粒白云岩、泥晶灰岩、含灰白云岩和白云岩组成(图 2), 上部未见顶。其中砂砾岩、砂岩均为中、薄层状, 分布在剖面底部, 向上逐渐过渡为中、薄层深灰色白云岩与中、厚层深灰色、黑色页岩、油页岩的互层。经实测, 芦草沟组出露厚度为270.62 m。
 | 图2 红雁池南剖面中二叠统芦草沟组实测柱状图Fig.2 Lithofacies charateristics of the Middle Permian Lucaogou Formation at southern Hongyanchi section |
该剖面中二叠统芦草沟组中常见鳕鱼鱼鳞(图 3-A)、淡水双壳类(古米台蚌和炭蚌)(图 3-B)介壳、芦木茎和叶等化石, 表明沉积环境为陆相淡水— 半咸水湖泊环境。芦草沟组自下而上碎屑岩含量逐渐减少, 黑色页岩、油页岩厚度增大, 并出现深灰色碳酸盐岩, 且在剖面中上部的黑色页岩及深灰色白云岩中还可见星点状黄铁矿微粒(图 3-C), 表明湖泊水体逐渐加深, 沉积环境也由滨湖、浅湖渐变为缺氧、还原的半深湖环境(图 2)。
研究区白云岩中白云石含量介于55.2%~100%之间, 可分为泥晶白云石和粉晶白云石, 前者约占85%~90%。泥晶白云石粒径约3~10, μ m, 主要为微晶(dolomicrosparstone, < 4, μ m, Wright, 1992)和微亮晶(dolomicrostone, 4~10, μ m), 经茜素红与铁氰化钾配比溶液染色呈无色或蓝绿色, 表明部分白云石含铁。以HYC-27号样品为例, 白云石含量54%, 铁白云石含量6%, 镜下呈团块状、云朵状集合体, 颜色混浊灰暗(图 3-D, 3-E), 富有机质, 偶见微体化石碎片(图 3-D)。粉晶白云石、铁白云石充填在裂缝及溶洞内, 似为裂隙充填的胶结物, 或早期泥晶白云石发生了重结晶作用所致(图 3-D, 3-E)。此外, 泥晶白云石、粉晶白云石阴极发光特征也不相同, 粉晶白云石发光较为明亮, 泥晶白云石发光强度弱、发均匀昏暗的砖红色光(图 3-F)。文中的泥晶白云石与埋藏成岩期经交代或重结晶作用改造过的自形程度高、镶嵌式接触、粒径较粗的次生白云石(黄志诚等, 1996)不同, 表明泥晶白云石可能是在低温快速成核条件下形成的。此外, 在白云岩中发现的古鳕鱼鳞片(图 3-A)及微体化石碎片等也从侧面反映了研究区白云岩地层基本保持了形成时的初始状态, 未遭受强烈的后期成岩作用改造。
扫描电镜下, 研究区白云石的微形态主要包括微球状、微簇状和他形3类(图 4)。微球状白云石直径约5~8, μm, 表面粗糙(图 4-B)且具有显微纹层结构, 放大至6万倍后发现, 显微纹层是由无数的纳米级微粒(几十到100 nm左右)密集排列粘结构成的纳米颗粒层, 很可能属于与微生物代谢作用有关的生长纹层(图 4-A, 4-B)。在纹层的最外侧还分布有垂直纹层表面生长的纳米级针状物(图 4-A虚线箭头所指)。尽管目前关于纳米微粒(nanoparticles, 50~300 nm)能否作为完整的生命载体还存在很大争论(Folk, 1993; Maniloff, 1997; Ciftcioglu et al., 2006; Perri and Tucker, 2007; Sánchez-Román et al., 2008), 然而, 文中这些纳米级的白云石微粒和纳米针显然是构成微球状白云石的最基本单位, 因此它们对于微球状白云石的形成至关重要。簇状白云石(图 4-C)集合体中单个微管状白云石长度为0.1~0.3, μ m, 横截面直径约80 nm, 密集地连结为簇状, 周围伴生大量长度不足0.1, μ m的白云石微粒聚集体。他形白云石由大量直径约0.25, μ m的球状及椭球状微粒聚集粘结构成(图 4-D)。
白云岩的碳、氧同位素值与成岩介质的盐度、温度和微生物活动等有关, 对岩石的形成环境具有一定的指示意义(Mazzullo et al., 1995; Boetius et al., 2000; Mazzullo, 2000; Roberts et al., 2004; Wacey, 2007; 李波等, 2010; Sánchez-Román et al., 2011)。研究表明, 与硫酸盐还原作用、甲烷厌氧氧化作用及嗜盐喜氧菌的有氧呼吸作用有关的碳酸盐矿物(方解石和白云石)碳同位素总体呈现强烈负偏的特征(Alperin et al., 1988; Whiticar, 1999; Boetius et al., 2000; García del Cura et al., 2001; van Lith et al., 2003; Sánchez-Román et al., 2009b, 2011; Deng et al., 2010), 而与产烷带甲烷生成作用相关的白云石碳同位素则多为正偏(Mazzullo, 2000; Roberts et al., 2004; Kenward et al., 2009; Meister et al., 2011)。
研究区9个岩石样品的碳、氧同位素值见表1。其中
| 表1 红雁池南剖面中二叠统芦草沟组湖相碳酸盐岩碳、氧同位素组成 Table1 Carbon and oxygen isotope composition of carbonates of the Middle Permian Lucaogou Formation in southern Hongyanchi section |
将研究区白云岩碳同位素与La Roda、Abu Dhabi等地区白云石(与硫酸盐还原菌有关)(García del Cura et al., 2001; Deng et al., 2010)及Brejo do Espinho潟湖的微生物白云石(与嗜盐喜氧菌有关)碳同位素(Sánchez-Román et al., 2009b)相比, 均显示明显正偏的特征。与甲烷厌氧氧化产生同位素极度负偏的碳酸盐(Boetius et al., 2000; Mazzullo, 2000; Meister et al., 2007)相比也有很大差异。此外, 将碳、氧同位素值投在Mazzullo(2000, Fig.2)“ 与缺氧、富有机质有关的海相沉积物中白云石的地球化学特征” 图上, 发现研究区白云岩的碳、氧同位素值均位于产烷带微生物活动造成甲烷生成作用相关的白云石的稳定同位素值范围内(图 5)。因此, 研究区白云岩的碳同位素正偏表明其形成可能与产烷带微生物代谢活动引起的甲烷生成作用有关。
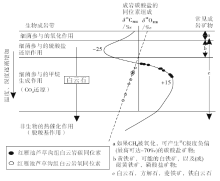 | 图5 红雁池南剖面中二叠统芦草沟组碳酸盐岩碳、氧同位素值分布(底图图版引自Mazzullo, 2000, Fig.2)Fig.5 |
研究区氧同位素与中二叠世平均海水氧同位素(Korte et al., 2005, 260.5~272.5, Ma,
综上所述, 认为研究区白云岩氧同位素的变化可能指示了白云岩形成于以蒸发作用为主的陆相湖泊较深水环境。
乌鲁木齐地区红雁池南剖面中白云岩的显微岩石学分析、化石保存状况及阴极发光特征表明, 白云岩未遭受埋藏成岩期的强烈改造, 泥晶白云石缺乏次生交代证据, 保存了丰富的原始信息, 为与现代实验合成的微生物白云石进行对比提供了可能。研究区具有显微纹层结构并以纳米质点为基本单位的微米级球状白云石、微簇状白云石及纳米级微球聚集而成的他形白云石的微形貌具有微生物矿化的特征(图 4), 很可能属于与微生物有关的原生白云石。将其与实验室合成的微生物白云石(Sánchez-Román et al., 2008, Fig.2, Fig.3A; Sánchez-Román et al., 2009a, Fig.3, Fig.4)的显微形态、结构对比, 球状微粒及其表面纳米级颗粒是微生物白云石的共同特点之一。此外, 研究区芦草沟组白云石与青海湖底现代沉积物中的微生物白云石(于炳松等, 2007)、澳大利亚Coorong潟湖的微生物白云石(Wright, 1999)、英属西印度群岛Cayman Brac钟乳石中报道的微生物白云石(Jones, 2010)等的显微形态也非常相似。
产甲烷菌的活动可以引起有机物质碳同位素分馏, 形成贫13C的CH4和富13C的CO2(William and Silverman, 1965; Games et al., 1978; 张晓宝等, 2000), 富含13C 的CO2溶于孔隙水并进入矿物晶格, 可以造成岩石中δ 13C值偏高。张晓宝等(2000)通过碳同位素特征认为该地区白云岩与厌氧条件下发酵带中细菌作用造成有机物质碳同位素分馏有关。而研究区地层中黑色泥岩和页岩中有机质丰富, 是北疆地区最重要的烃源岩, 白云岩δ 13C的明显正偏也与前人研究基本一致。因此, 综合白云石的显微形态学及同位素特征分析, 认为研究区白云石的沉淀很可能与产烷带产甲烷菌的代谢活动引起的甲烷生成作用有密切的关系。
研究区芦草沟组泥晶白云岩中存在微球状、微簇状及他形等3种显微形态的白云石, 其中微球状白云石具有显微纹层结构, 而显微纹层又是由数量众多的纳米级微粒粘结而成。白云石的显微形态与已报道的自然界产出的以及实验室合成的微生物白云石非常相似。此外, 该剖面的碳酸盐岩和黑色页岩富含有机质、白云岩偏高的碳同位素值等特征暗示了产甲烷菌的代谢活动引起的甲烷生成作用与白云石的沉淀密切相关。因此, 研究区中二叠统芦草沟组泥晶白云岩中具有上述特殊形貌的白云石很可能是与产甲烷菌等微生物有关的原生白云石。
致谢 论文完成过程中,主编冯增昭教授、中国科学院地质与地球物理研究所吴亚生研究员、以及两位匿名评审专家给予了精心的指导和帮助,他们的意见和建议显著提高了论文的质量,笔者在此表示衷心的感谢!
作者声明没有竞争性利益冲突.
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
|
| 8 |
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
|
| 13 |
|
| 14 |
|
| 15 |
|
| 16 |
|
| 17 |
|
| 18 |
|
| 19 |
|
| 20 |
|
| 21 |
|
| 22 |
|
| 23 |
|
| 24 |
|
| 25 |
|
| 26 |
|
| 27 |
|
| 28 |
|
| 29 |
|
| 30 |
|
| 31 |
|
| 32 |
|
| 33 |
|
| 34 |
|
| 35 |
|
| 36 |
|
| 37 |
|
| 38 |
|
| 39 |
|
| 40 |
|
| 41 |
|



