通讯作者简介 刘波,男,1965年生,博士,北京大学教授,博士生导师,主要从事沉积学和构造地质学研究。E-mail: bobliu@pku.edu.cn。
近年来,随着对微生物白云石模式研究的不断深入,为解释“白云石问题”提供了新思路。前人对微生物白云石成因研究侧重于微生物对未固结沉积物的改造,即有机准同生白云石化作用,这与实验室中以微生物为媒介形成的“有机原生白云石”在成因机理上存在差异。笔者将微生物白云石机理引入湖相原生白云石成因解释中,认为在湖水—沉积物交界处也会发生微生物成因的原生白云石沉淀,即有机原生白云石。湖水与沉积物交界处的微环境存在明显区别,总体可分为有氧和缺氧 2种亚环境,不同亚环境中生活有不同的微生物群落。根据湖泊亚环境特性和微生物种类及其在白云石形成过程中所发挥的作用,可以区分出细菌有氧氧化模式、硫酸盐还原模式和产甲烷模式 3种微生物白云石模式。不同模式对应于不同的湖泊环境: 细菌有氧氧化模式主要发生于有氧、高 Mg/Ca值的咸水 /盐湖环境;硫酸盐还原模式主要发生于缺氧、高 Mg/Ca值的咸水 /盐湖环境;产甲烷模式主要发生于缺氧、低 Mg/Ca值的淡水 /咸水湖环境。另外,还探讨了 pH值变化、 S
About the first author Jiang Qicai,born in 1992,is a Ph.D. candidate of Peking University. He is engaged in sedimentology. E-mail: jiangqc@pku.edu.cn.
About the corresponding author Liu Bo,born in 1965,is a professor and Ph.D. supervisor in Peking University. He is engaged in sedimentology and structural geology. E-mail: bobliu@pku.edu.cn.
第一作者简介 蒋启财,男, 1992年生,博士研究生,主要从事沉积学研究。 E-mail: jiangqc@pku.edu.cn。
Recently,with the in-depth research on the microbial dolomite mode,a new perspective on Dolomite Problem has been provided. Previous researches on the origin of microbial dolomite mainly focused on the microbial processes in unconsolidated sediments,which equals to organic penecontemporaneous dolomitization. It differs from bacteria ̄induced organic primary dolomite in laboratory in mechanism. This study introduces the formation mechanism of microbial dolomite into lacustrine primary dolomite,concluding that it would also precipitate primary dolomite in the interface between lake water and sediment,organic primary dolomite. There is a distinction between lake water and sediment in microenvironment of interface,which can be generally divided into two subenvironments: Aerobic and anaerobic,living with different microflora. According to the subenvironments' characteristics of different lake types,different microorganism species and their various role in the formation of dolomite,three microbial dolomite modes can be distinguished,which are the aerobic oxidation mode,the sulphate reduction mode and the methanogenesis mode. Different modes of the microbial dolomite correspond to different lake environments: The aerobic oxidation mode mainly develops in aerobic,high Mg/Ca,salt water lake/saline. The sulphate reduction mode mostly develops in anaerobic,high Mg/Ca,salt water lake/saline. The methanogenesis mode primarily develops in anaerobic,low Mg/Ca,freshwater lake/salt water lake. Moreover,some still-controversial issues on the process of dolomite precipitation will be discussed,such as the changing of pH,the effect of S
白云石(CaMg(CO3)2)是斜方晶系的碳酸盐岩, 属于三方或六方晶系。理想状态下, 白云石是由相同数量的Ca2+和Mg2+组成(Ca2+︰Mg2+=50︰50)的有序的碳酸盐矿物(Tucker and Wright, 1990)。原生白云石, 最初是由Golsmith和Graf(1958)在人工合成白云石的过程中提出的, 是指富钙、低有序度的钙镁碳酸盐(钙白云石), 其在成分上是介于镁方解石和理想白云石之间的一种过渡性矿物。人工合成的白云石和现代沉积的白云石在成分和晶体结构有序性方面都比较类似。多数天然形成的白云石, 也并不是化学计量的, 而是含有过量的Ca2+, Ca2+︰Mg2+值达到58︰42(Tucker and Wright, 1990)。在白云石的成熟化过程中, 天然形成的白云石会逐渐向有序、化学计量的白云石转化(Land, 1985; Hardie, 1987; Vasconcelos and McKenzie, 1997)。
白云石广泛发育于古代地层中, 而在全新世沉积物中却非常罕见(Warren, 2000)。常温常压(常温25, ℃、常压1 atm)条件下, 实验室不能沉淀出白云石矿物晶体(Land, 1998; Wright, 1999; Warthmann et al., 2000; van Lith et al., 2003a; Wright and Wacey, 2005; Wacey et al., 2007), 其原因众说纷纭, 尚无定论, 这即为困扰沉积学家长达2个世纪之久的“ 白云石问题” 。白云石的形成主要受控于反应动力机制(Morrow, 1982; Morse, 2003), 因此, 自然界中白云石如何打破动力学障碍而沉淀出来成为解决“ 白云石问题” 的关键。早在20世纪中期, 前人就已经在厌氧生物实验中发现了白云石晶体的沉淀(Nadson, 1928; Neher and Rohrer, 1959)。Vasconcelos和McKenzie(1997)通过对巴西Lagoa Vermelha潟湖现代白云石的研究, 正式提出了“ 微生物白云石模式” (Microbial dolomite model), 强调了硫酸盐还原菌新陈代谢活动对白云石(钙白云石)沉淀过程的直接促进作用, 即“ 硫酸盐还原模式” 。随后, 地质学家根据实验室研究结果相继提出了“ 甲烷厌氧氧化模式” (Hinrichs et al., 1999)、“ 产甲烷模式” (Roberts et al., 2004)和“ 细菌有氧氧化模式” (Sá nchez-Romá n et al., 2008)。微生物白云石模式在发展过程中也受到部分学者质疑(如: Gregg et al., 2015), 而微生物的介导作用是唯一被证实的能在地表条件下促使原生白云石沉淀的机理(Bontognali et al., 2010), 且Zhang等(2012a, 2012b)提出在常温条件下多糖类有机物、溶解的硫化物对无序白云石的沉淀也具催化作用, 其与微生物白云石的形成机制可能具有相似性, 这均为解决原生白云石沉淀问题开拓了思路。
湖相白云岩是白云石研究领域中的特殊一类, 尽管发育规模较小, 但形成机制的多样性并不亚于海相白云石(Last, 1990)。总体上, 湖相白云石成因机理可分为2种: 原生沉淀和次生交代。而在众多湖相白云石实例研究中, 并无充分证据证明白云石是原生成因还是次生交代成因(Bowen et al., 2008)。黄成刚等(2016)对湖相白云石的成因模式进行了总结, 包括原生生物成因模式、准同生交代成因模式、热液交代成因模式和热液喷流型原生白云石化成因模式, 并认为原生生物成因模式属于白云石化模式的一类。
| 表1 国内外湖相微生物白云石研究实例 Table1 Case studies of lacustrine microbial dolomite at home and abroad |
在微生物白云石实例研究中, 多数学者侧重于在海底/湖底沉积物的垂向分带中不同微生物群落诱导的白云石化作用(Mazzullo, 2000; Morad, 2009; 李红和柳益群, 2013), 其属于有机准同生白云石化范畴, 即在沉积物沉淀之后、未固结成岩之前发生的白云石化, 形成时间段类似于萨勃哈白云石化(无机准同生白云石化), 都是晶体格架内Mg2+置换Ca2+的结果, 而非严格意义上的原生沉淀白云石。这与实验室中微生物诱导沉淀的原生白云石在形成机理上存在明显差异。基于上述理论探讨, 结合湖泊底层水与富有机质沉积物交界处含氧条件的分析, 笔者将原生微生物白云石成因机理引入到湖相原生白云石的成因解释中, 系统总结了湖泊底层水中不同微环境下的微生物白云石模式机理, 拟为湖相微生物白云石研究提供一种新视角。
湖相白云石可形成于不同水文地质环境的湖泊系统中(Deelman, 2003)。Last(1990)指出湖相原生白云石主要发育于盐湖或超盐湖环境中。近年来, 随着对微生物白云石研究的深入, 国内外发现了越来越多不同湖泊环境中的微生物白云石实例(表 1)。根据湖水盐度, 湖泊可划分为4种: 盐湖(> 35 g/L)、咸水湖(1~35 g/L)和淡水湖(< 1 g/L)。截至目前, 盐湖的微生物白云石成因主要为硫酸盐还原菌模式, 淡水湖或咸水湖的微生物白云石成因主要为产甲烷模式或细菌有氧氧化模式(表 1)。然而, 湖相微生物白云石的研究主要集中在盐湖环境, 硫酸盐还原成因模式居多, 这可能与微生物白云石模式最早建立在超盐湖环境下(Vasconcelos and McKenzie, 1997)且硫酸盐还原菌具很强的环境适应能力(冯继光和胡宝群, 2008)有关。众多实例研究的微生物白云石并非严格意义上的原生沉淀白云石, 多数侧重于在湖底沉积物的成岩分带中不同微生物群落诱导的白云石化作用。那么地表环境下是否存在类似于实验室中以微生物为媒介形成的原生白云石?答案是肯定的, 因为湖泊底层水存在与实验室中微生物培养基相似的微环境, 能促使白云石沉淀。
湖泊水体可依据盐度和温度进行分层, 不同层中的湖水有着相对独立的化学特征(Gierlowski-Kordesch, 2010)。淡水湖主要按温度分层, 自上而下划分为变温层、斜温层和均温层; 盐湖或咸水湖(半对流湖泊)主要按盐度分层, 自上而下划分为混合层、化跃层和永滞层。尤其在深且窄的湖泊中更 易分层(Garcé s et al., 1995)。根据湖泊底层水含氧条件的差异, 可分为有氧和缺氧2种亚环境, 缺氧亚环境可季节性出现于淡水湖的均温层中, 以及永久性出现于盐湖或咸水湖的永滞层中(Wetzel, 2001; Loeffler, 2007)。通过将多个湖相微生物白云石实例与实验室研究对比表明, 将取自湖泊的细菌置于与湖泊相似的微环境(含氧量、盐度、温度、pH值、Mg/Ca值)中进行实验培养, 所沉淀出的白云石在微形态上与湖水— 沉积物界面附近的白云石非常相似(图 1)。例如, 当水— 沉积物界面为有氧微环境时, 在嗜盐需氧细菌的介导下, 无论在实验室还是湖水— 沉积物界面沉淀出的白云石都具有相似的球粒状形态(图 1-1, 1-2, 1-3, 1-4)(Sá nchez-Romá n et al., 2008, 2009a, 2009b); 而当水— 沉积物界面为缺氧微环境时, 在硫酸盐还原菌介导下, 无论在实验室还是湖水— 沉积物界面沉淀出的白云石都具有相似的次球状形态(图 1-5, 1-6, 1-7, 1-8)(Vasconcelos and McKenzie, 1997; Vasconcelos et al., 2005; Wright and Wacey, 2005)。
 | 图1 湖相微生物白云石与微生物培养基白云石的微形态对比Fig.1 Micromorphology comparison between lacustrine microbial dolomite and microbial culture medium dolomite |
不同亚环境下生活有不同的微生物种类, 有氧亚环境生活有需氧菌, 缺氧亚环境生活有硫酸盐还原菌(SRB)或产甲烷菌。根据湖泊有氧和缺氧2种亚环境以及微生物种类不同及其在白云石形成过程中所发挥的作用, 将湖相微生物白云石模式机理划分为有氧亚环境下的细菌有氧氧化模式, 缺氧亚环境下的硫酸盐还原模式和产甲烷模式。
地表条件下, 白云石的形成过程存在动力学阻碍(Krauskopf, 2010), 主要包括3个方面: (1)镁离子的高水合能(Lippmann, 2012)。低温条件下Mg2+以水化合物或络合物的形式存在(Pytkowicz and Hawley, 1974), 不易进入白云石晶格, 因此阻碍了过饱和溶液中白云石的沉淀; (2)碳酸根离子溶度和活度低(Garrels and Thompson, 1962), 不能克服Mg2+的水合层而与镁结合(Lippmann, 2012); (3)硫酸根离子对的存在。Mg2+常与S
微生物在白云石沉淀过程中起“ 催化作用” (Wacey et al., 2007)。上述3种微生物白云石诱导机制(细菌有氧氧化模式、硫酸盐还原模式以及产甲烷模式)的共同特征是不仅能提高溶液pH值、C
当湖泊底层水与沉积物交界处为有氧条件时, 在需氧细菌参与下会发生有氧氧化作用, 化学反应式为:
2C3O3H7N+5O2→ 6HC
需氧细菌的新陈代谢活动及细胞内的反应过程如图2所示。从图2和反应式可以看出, 需氧细菌在降解有机质(含氮有机质)过程中, 会释放出CO2、N
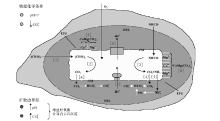 | 图2 需氧菌参与下的白云石沉淀过程(修改自Corzo et al., 2005)Fig.2 Schematic model showing the major processes involved in the precipitation of dolomite by aerobic bacteria(modified from Corzo et al., 2005) |
需氧细菌细胞被有效扩散边界层(DBL)包围, 为暗灰色区域, 其周围环境为灰色区域。周围环境的低分子量有机质化合物进入细胞[1], 它们与O2发生反应生产CO2[2], 或含氮有机质进入细胞通过代谢释放CO2和NH3[3]。[2]和[3]形成的CO2释放到DBL[4], NH3反应形成N
当湖泊底层水与沉积物交界面为缺氧环境且硫酸盐溶度达到一定值时, 有机质在硫酸盐还原菌的作用下会发生矿化(Fenchel and Finley, 1995)。缺氧条件下, 硫酸盐还原菌把S
2CH2O(有机质)+S
如果溶液中含Fe2+, 就会出现原生草莓状黄铁矿与微生物白云石共生, 其原理是Fe2+与式(2)中生成的H2S反应生成黄铁矿(Berner, 1980)。综合反应如下:
15CH2O(有机质)+8S
硫酸盐还原菌细胞被有效扩散边界层(DBL)包围, 为暗灰色区域, 其周围环境为灰色区域。周围环境的低分子量有机质化合物进入细胞[1], 它们被氧化成CO2[2], 释放到DBL[3]。有机质氧化形成的离子穿过细胞电子运移的细胞膜(CM)[4]至S
| 2CH2O+2H2O → 2CO2+4H2(厌氧氧化/发酵) | [2] |
|---|---|
| CO2+H2O → HC | [3] |
| S | [5] |
| 2C | [8] |
硫酸盐还原菌的新陈代谢活动及细胞内的反应过程如图3所示。从图3和反应式可以看出, 硫酸盐还原菌在降解有机质过程中, 会降低溶液中的S
 | 图3 硫酸盐还原菌参与下的白云石沉淀过程(修改自Corzo et al., 2005)Fig.3 Schematic model showing the major processes involved in the precipitation of dolomite by sulfate-reducing bacteria(modified from Corzo et al., 2005) |
3.3.1 产甲烷模式 当湖泊底层水与沉积物交界处为缺氧条件时, 产甲烷菌新陈代谢活动能诱导白云石沉淀。该沉淀过程不一定需要高饱和度和高Mg/Ca值(Roberts et al., 2004)。目前已发现有2种产甲烷菌能诱导白云石沉淀, 其反应机理分别为:
CH3COO-+H2O→ CH4+HC
或 2CH2O+H2O→ CH4+HC
产甲烷菌的新陈代谢活动及细胞内的反应过程如图4(左)所示。从图4和反应式可以看出, 产甲烷菌的新陈代谢活动提高了溶液HC
产甲烷菌和硫酸盐还原菌细胞被有效扩散边界层(DBL)包围, 为暗灰色区域, 其周围环境为灰色区域。周围环境的低分子量有机质化合物进入细胞[1], 它们厌氧发酵生产CH4和CO2[2], CH4形成后向上扩散至SMT带进入产甲烷菌和SRB细胞中[3], 与S
3.3.2 甲烷厌氧氧化模式 甲烷形成后会扩散到硫酸盐还原带和甲烷生成带之间的过渡带: 硫酸盐— 甲烷过渡带(SMT)。在SMT中, 受产甲烷菌和硫酸盐还原菌微生物群落的调节, 会发生甲烷厌氧氧化反应(AMO)(Boetius et al., 2000), CH4以S
CH4+S
如果溶液中含Fe2+, 则会形成铁白云石(Roberts et al., 2004), 反应如下:
3HC
产甲烷菌和硫酸盐还原菌的新陈代谢活动及细胞内的反应过程如图4(右)所示。从图4和反应式可以看出, 甲烷厌氧氧化反应降低了溶液中S
 | 图4 产甲烷菌和硫酸盐还原菌参与下的白云石沉淀过程(修改自Corzo et al., 2005)Fig.4 Schematic model showing the major processes involved in the precipitation of dolomite by methanogenic Archaea and sulfate-reducing bacteria(modified from Corzo et al., 2005) |
不同湖泊环境下的微生物白云石可能更为常见, 时空分布更为广泛。Krause等(2012)发现在缺氧、低温(21, ℃)的现代海水化学中(正常盐度和Mg/Ca值), 硫酸盐还原菌也可以介导白云石的沉淀, 这丰富了人们对硫酸盐还原模式发育环境的认识, 即从小空间规模、超盐性环境扩展到全球规模的海洋/湖泊环境。最新研究表明, 硫酸盐还原模式可以发生于咸水湖, 如中国青海湖湖底的微生物白云石成因与硫酸盐还原模式有关(Deng et al., 2010)。因此, 若要建立起湖泊环境与微生物白云石模式的对应关系, 首先需要考虑微生物群落在不同环境下的分布情况。
截至目前, 能诱导湖相白云石沉淀的微生物类型主要有硫酸盐还原菌(SRB)、产甲烷菌、嗜盐需氧细菌以及蓝细菌微生物(表 1)。水体盐度对不同种类的微生物群落的生长和新陈代谢活性均有重要的影响。硫酸盐还原菌可在盐度大于1 g/L湖水中生存(杨渐等, 2013), 最佳的生长盐度为100 g/L, 上限为240 g/L(Warthmann et al., 2005; Belyakova et al., 2006; Kjeldsen et al., 2007)。高盐度对产甲烷菌有很强的抑制作用(Baldwin et al., 2006; 曾志华等, 2014), 产甲烷菌最佳的生长盐度为0.23~0.35 g/L(Rinzema et al., 1988), 上限为25, g/L(Vallero et al., 2003)。对于异养需氧细菌, 未有明确的存活盐度范围, 其在实验培养基下盐度均为35, g/L(Sá nchez-Romá n et al., 2008, 2009b)。因此, 盐湖中生活有硫酸盐还原菌和需氧菌; 咸水湖中生活有硫酸盐还原菌、产甲烷菌和需氧菌; 淡水湖中生活有产甲烷菌。
不同类型湖泊下的不同亚环境生活有不同的细菌种类, 会发生不同的微生物白云石模式(图 5): 盐湖有氧/缺氧亚环境发生的微生物白云石模式分别为有氧氧化模式和硫酸盐还原模式; 咸水湖有氧/缺氧亚环境发生的微生物白云石模式分别为有氧氧化模式和硫酸盐还原模式以及产甲烷模式; 淡水湖缺氧亚环境发生的微生物白云石模式为产甲烷模式, 而有氧亚环境不发生微生物白云石沉淀。该结论与目前实例研究相符合且范围更为广泛和全面。因此, 可初步总结出不同成因模式与湖相环境的对应关系: 细菌有氧氧化模式主要形成于有氧、高Mg/Ca值的咸水/盐湖环境; 硫酸盐还原模式主要形成于缺氧、高Mg/Ca值的咸水/盐湖环境; 产甲烷模式主要形成于缺氧、低Mg/Ca值的淡水/咸水湖环境。
众所周知, 湖相微生物白云石可以形成于湖底沉积物成岩分带中的有机准同生白云石化作用下, 但笔者认为在湖水— 沉积物交界处也会发生原生微生物白云石沉淀, 且与实验室中微生物诱导沉淀的原生白云石在形成机理上更为一致。总体上, 微生物白云石模式与湖泊环境具有特殊对应关系: 细菌有氧氧化模式主要形成于有氧、高Mg/Ca值的咸水/盐湖环境; 硫酸盐还原模式主要形成于缺氧、高Mg/Ca值的咸水/盐湖环境; 产甲烷模式主要形成于缺氧、低Mg/Ca值的淡水/咸水湖环境。由于湖泊体系的多变性与微生物白云石沉淀机理的复杂性, 其对应关系仍需要细化研究, 尤其在微生物白云石形成机理研究上仍存在许多亟待解决和值得探讨的问题:
1)pH值变化的争议。目前普遍认为在微生物参与的白云石沉淀过程中, 溶液的pH值会升高。一方面, 与微生物的新陈代谢有关; 另一方面, 可能与反应产生的CO2的脱气作用有关(70%以上的CO2会发生脱气)(Sá nchez-Romá n et al., 2009b)。然而有研究发现, 在硫酸盐还原模式中溶液的pH值会轻微降低(Corzo et al., 2005; de Lomas et al., 2005), 当前的解释为当硫酸盐还原作用层接近含氧层时, H2S氧化生成的H+会减缓由硫酸盐还原作用引起的H+的减少。另外, 李波等(2011)也指出在有氧氧化模式中, 溶液的pH值会有所降低, 但并未作出解释。出现对pH值变化的争议, 主要是因为在微生物活动过程中, H+平衡发生在细胞膜, 微生物生长和活动对外部pH的影响无法精确估算(Corzo et al., 2005), 并且溶液中H+溶度变化会引起大量复杂的生物和非生物过程, 包括碳酸盐的溶解和沉淀(Visscher et al., 1998; Mucci et al., 2000)。
2)S
3)硫化物对镁水合物脱水的影响。Zhang等(2012a)证实了在碳酸盐表面吸附的溶解硫化物可以促进镁水合物脱水, 增加镁离子活度, 促使白云石沉淀。Yang等(2012)通过分子动力学的模拟计算, 指出在水溶液中HS-不具有以类似氢键的形式使镁水合物脱水的能力, 也可能是HS-通过其他机制使镁水合物脱水。这些研究对于理解硫酸盐还原菌的作用和沉积白云石的形成机理具有启发作用。然而, 细菌有氧氧化模式和产甲烷模式形成的白云石不与硫化物共生, 在沉淀过程中又是何种机制减低镁离子的高水合能的?需要今后进一步的研究。
4)微生物白云石沉淀的环境因子。前人研究主要集中在钙镁离子溶度、碳酸根离子溶度、硫酸根离子溶度、温度、盐度和pH值方面, 宋泉颖等(2014)证实了高压和高微生物代谢活性有利于微生物介导白云石沉淀, 因而增加了压力和微生物种类(微生物代谢活性)这2个影响因子, 进一步完善了微生物白云石模式。
作者声明没有竞争性利益冲突.
作者声明没有竞争性利益冲突.
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
|
| 8 |
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
|
| 13 |
|
| 14 |
|
| 15 |
|
| 16 |
|
| 17 |
|
| 18 |
|
| 19 |
|
| 20 |
|
| 21 |
|
| 22 |
|
| 23 |
|
| 24 |
|
| 25 |
|
| 26 |
|
| 27 |
|
| 28 |
|
| 29 |
|
| 30 |
|
| 31 |
|
| 32 |
|
| 33 |
|
| 34 |
|
| 35 |
|
| 36 |
|
| 37 |
|
| 38 |
|
| 39 |
|
| 40 |
|
| 41 |
|
| 42 |
|
| 43 |
|
| 44 |
|
| 45 |
|
| 46 |
|
| 47 |
|
| 48 |
|
| 49 |
|
| 50 |
|
| 51 |
|
| 52 |
|
| 53 |
|
| 54 |
|
| 55 |
|
| 56 |
|
| 57 |
|
| 58 |
|
| 59 |
|
| 60 |
|
| 61 |
|
| 62 |
|
| 63 |
|
| 64 |
|
| 65 |
|
| 66 |
|
| 67 |
|
| 68 |
|
| 69 |
|
| 70 |
|
| 71 |
|
| 72 |
|
| 73 |
|
| 74 |
|
| 75 |
|
| 76 |
|
| 77 |
|
| 78 |
|
| 79 |
|
| 80 |
|
| 81 |
|
| 82 |
|
| 83 |
|
| 84 |
|
| 85 |
|