第一作者简介 李妲,1984年生,女,讲师,博士,主要从事沉积学、古生物学、遗迹学等研究工作. E-mail: lida@hpu.edu.cn。
埃迪卡拉纪以来,微生物与后生动物之间呈此消彼长的关系,但在寒武纪苗岭世却出现了微生物成因沉积构造和后生动物扰动构造短暂共存的现象。笔者在豫西馒头组二段下部识别出包括皱饰构造与微生物席裂构造在内的2种微生物成因沉积构造,对皱饰构造与遗迹化石的共生关系进行了分类,建立了席上足辙迹(Monomorphichnus henanensis)与牧食迹(Jinningichnus badaowanensis)、席下水平漫游迹(Planolites montanus)、席下深层泥岩中生物扰动共3种微生物席与后生动物的共生模式和生态演化模型。上述研究表明,具有特殊环境耐受性的“机会主义”动物在食物来源较为宽松的潮坪环境中与微生物席共存,这种微生物席与后生动物短暂而“和谐”的共存关系不仅延续了埃迪卡拉纪双方的部分共生特征,且在以混合底为主导的显生宙生态环境中得到了进一步变化与发展。
About the first author LI Da,born in 1984,lecturer,is mainly engaged in researches of sedimentology,paleontology and ichnology. E-mail: lida@hpu.edu.cn.
Since the Ediacaran period,the microbes and metazoan were interacted,but microbial induced sedimentary structures(MISS)and metazoan bioturbation structures coexisted temporarily in the Cambrian Miaoling age. In this paper,two types of microbially induced sedimentary structures,including wrinkle structures and microbial mat-crack structures,are identified in the lower part of the Second Member of the Mantou Formation in western Henan Province. The symbiotic relationship between MISS and trace fossils was classified,and three models of the symbiotic relationship between the wrinkle structures and metazoans and ecological evolution model of microbial mat and metazoan were established, including the trackways( Monomorphichnus henanensis)and the grazing trace( Jinningichnus badaowanensis)on the microbial mat, Planolites montanus under microbial mat, and the burrows in mudstone substrate. It showed that some organisms with special environmental tolerance coexisted with microbial mats in the tidal environment with relatively sufficient food sources,revealing the short period of harmonious coexistence relationship between microbial mat and metazoans not only continued the partial symbiotic characteristics during the Ediacaran,but also developed in the mixground-dominated Phanerozoic ecological environment.
微生物席是由数量庞大、成员间依赖关系复杂的微生物群落所构成, 因其具有复杂性、持久性和规模庞大, 从而成为地球上最独特的生态系统之一(Hagadorn and Bottjer, 1999; Bailey et al., 2006; Bayet-Goll and Daraei, 2020)。皱饰构造是识别微生物席最直接和明显的证据(梅冥相, 2014), 众多学者对新元古代、甚至太古宙时期的皱饰构造做了大量研究, 并对不同时期皱饰构造的形成机制与沉积环境等问题进行了详细论述(Hagadorn and Bottjer, 1999; Noffke et al., 2002)。近年来, 一些学者已经开始探索后生生物和微生物席之间的相互作用(Mata and Bottjer, 2009; Má ngano and Buatois, 2011; Sarkar et al., 2016)。不同于显生宙, 前寒武纪皱饰构造的发育几乎不受后生动物扰动的影响, 可以更好地反映当时的沉积环境等, 而寒武纪大爆发后, 受后生生物勃发的影响, 微生物席底质开始逐渐破碎且被后生动物扰动为主导的混合底所取代, 海洋底质开始发生变化(Buatois and Má ngano, 2011)。在从微生物席底到生物扰动混合底的海洋底质转变过程中, 微生物与后生动物此消彼长的角斗也出现了短暂的和谐共生, 因此寒武纪成为研究微生物活动与后生动物扰动交替演化的关键时期, 是打开寒武纪底质革命大门的“钥匙”(齐永安等, 2012)。豫西寒武系馒头组二段出现了皱饰构造与遗迹化石的共生现象, 本研究希望通过分析该共生现象, 探究微生物席和后生动物的共存关系规律以及二者交替演化的控制因素。
登封地区位于河南省西北部(图1-B), 华北克拉通南缘。太古宙末期, 由阜平运动形成的初始克拉通基底经吕梁—中条运动后最终固化为华北地台, 寒武纪初期发育典型的陆表海克拉通沉积, 多以碳酸盐沉积为主, 其古水深变化可大致反映海平面变化趋势(孙大中和陆松年, 1987; 朱茂炎等, 2021)。寒武纪第三期晚期, 河南地区开始接受沉积, 整体为海进, 之后海平面不断上升, 至张夏期海平面达到最高(齐永安等, 2019)。
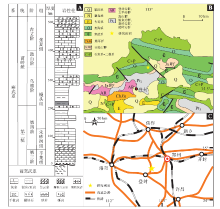 | 图1 河南登封第二统—苗岭统剖面位置与岩性柱状图 A—河南登封寒武系第二统与苗岭统岩性柱状图(据刘炳辰等, 2022, 有修改), 图中灰色阴影为主要研究层位; B—研究区地质图; C—河南登封地区交通图Fig.1 Section location and lithological column of the Series 2-Miaolingian in Dengfeng, Henan |
研究剖面位于河南登封关口涉村附近(图1-C), 寒武系连续发育(图1-A)。其中馒头组总厚241.87 m, 可分为3段: 馒头组一段以紫红色粉砂质泥岩为主, 可见水平和少量垂直(近垂直)滤食动物潜穴及大量生物活动遗迹, 下伏地层为朱砂洞组与辛集组; 馒头组二段上部为红褐色泥岩, 下部砂含量较多, 为紫红色页岩与黄绿色粉砂岩薄互层, 且可见较为丰富的皱饰构造与遗迹化石共存; 馒头组三段为厚层鲕粒灰岩夹透镜状泥质条带, 小区域可见数层微生物岩, 上覆张夏组(李妲等, 2016)。馒头组一段为潮坪相碎屑岩夹碳酸盐岩沉积, 馒头组二段、三段为潮坪相和浅海相碎屑岩沉积(齐永安等, 2019)。文中主要研究层位为馒头组二段下部, 厚度约15 m, 主要岩性为黄绿色粉砂岩与紫红色页岩互层, 由下向上粉砂质泥含量逐渐增多。
文中手标本取自登封剖面寒武系苗岭统馒头组二段下部。样品经过切片和拍照, 将较薄部分制成平行和垂直于皱饰构造表面的薄片, 并利用蔡司偏光显微镜与体视显微镜对薄片进行分析。另外, 根据生物扰动等级划分方法(Taylor and Goldring, 1993), 估计了研究层段生物扰动的强度。
微生物成因沉积构造包括皱饰构造和席裂构造, 主要发育在登封剖面馒头组二段下部。根据这2种微生物成因沉积构造的分布特征, 笔者将该段地层由下向上划分为A、B、C共3段(图2)。皱饰构造主要分布在A段黄绿色薄层粉砂岩层面, 少量分布于C段紫红色粉砂岩层面, 且自下向上皱饰构造纹理变大。C段除发育皱饰构造之外, 还可见微生物席裂构造。B段仅发育少量潜穴类遗迹化石。因此, 皱饰构造与遗迹化石共生现象主要发育在A、C段含大量皱饰构造的紫红色页岩与黄绿色粉砂岩互层中。研究层段生物扰动程度自下向上呈递减趋势, 整体较小, 生物扰动指数BI(Biothurbation Index)为1~2。自下向上粉砂质泥逐渐增多, 指示水体逐渐变浅、能量适中、相对强度差异较小。
2.1.1 皱饰构造特征 登封剖面馒头组二段下部所发育的皱饰构造主要分布于A、C段, 具有区域性和多样性, 整体呈大范围斑块状分布(图3-A), 多层叠覆发育(图3-B, 3-C, 3-D)。该时期整体环境适宜微生物席生长, 以蓝细菌为主导的微生物群落发育繁盛, 但未形成连续大面积分布, 说明此时后生物动物对微生物群落产生了影响, 微生物群落仅呈斑块状小区域分布。
A段为砂泥互层, 皱饰构造通常覆盖在薄层叠积的具有细密纹理的粉砂岩表面, 上覆紫红色泥页岩。皱饰构造一般不凸出于层面生长, 纹理较细小, 直径0.1~0.2 cm, 峰脊高约0.1 cm(图4-C, 4-E, 4-F)。C段为紫红色砂岩, 皱饰构造凸出发育于紫红色粉砂岩层面之上, 具有较大的波状纹理结构, 层面纹理直径0.2~0.5 cm, 峰脊高度0.2~0.3 cm(图4-A, 4-B)。该层段皱饰构造形态多样, 纹理排列方式与产出特征各异, 有的纹理弯曲复杂、常出现分叉、峰脊平滑(图4-A至4-C, 4-E), 有的则以不规则网状纹理及尖锐脊峰为特征(图4-D, 4-F)。此外, 在水流与风化共同作用下, 皱饰构造出现较为复杂的形态, 峰脊变得平滑(图4-B, 4-F), 造成研究区皱饰构造的多样性增加。
在样品的横截面上, 深色皱饰构造层厚约600 μ m(图5-A, 5-B, 5-D), 单偏光下粉砂岩与上覆皱饰构造明暗差别明显。与粉砂岩相比, 皱饰构造层矿物粒径较小且排列紧密(图5-B), 说明是微生物捕捉较小颗粒并形成微生物席。单个沉积物颗粒漂浮在不透明基质中(图5-C, 5-D), 也指示了微生物席对悬浮沉积物颗粒的捕捉与包裹(Noffke et al., 2002)。
2.1.2 微生物席裂构造 除皱饰构造外, 在登封剖面馒头组二段下部还同时识别出以席裂为主的“微生物成因沉积构造”(Microbially Induced Sedimentary Structures, 简称MISS)。席裂主要在C段紫红色粉砂岩中发育, 宽度为2~4 mm, 填充物为黄绿色粉砂岩(图6-A, 6-C), 干裂后可形成“U”形裂痕(图6-B)。
登封剖面馒头组二段下部发育的皱饰构造与席裂均具有一定的空间分布(图2), 说明其形成时的沉积环境存在差异。
2.2.1 皱饰构造发育的沉积环境 作为微生物成因沉积构造的一种, 皱饰构造除受到微生物群落的成因与后生动物的扰动影响外, 水动力条件、透光性与底质条件等环境因素对其发育也有巨大的影响(Hagadorn and Bottjer, 1999; Mata and Bottjer, 2009; 郭荣涛等, 2012; 邢智峰等, 2020)。豫西馒头组二段下部所发育的皱饰构造一定程度上反映了当时的水体深度、水动力强度以及底质等沉积环境条件, 文中结合前人研究成果与研究层段皱饰构造发育特征, 建立了皱饰构造发育控制因素模式(图7)。
目前, 普遍认为蓝细菌是皱饰构造的主要形成者(Gderdes et al., 2000; Noffke et al., 2006)(图7-A), 其通过光合作用进行新陈代谢, 可在低生物扰动的环境中形成微生物席, 进而发育为皱饰构造(钟怡江等, 2022)。在这一过程中, 首先, 良好的光照条件为微生物群落发展成为微生物席的关键因素, 因为透光区需要向水下延伸至生物群落所在的底质环境中以保证自养微生物的光合作用正常进行(Mata and Bottjer, 2009); 依据可用光合辐射(PAR, photosynthetically available radiation)对透光性因素进行定量分析表明, 当PAR>1%时, 皱饰构造开始发育(Kuwahara et al., 2000)(图7-C)。再者, 登封馒头组二段中的泥沙互层满足了干净、少泥质的粉砂质底质条件(图7-B), 为皱饰构造良好的发育场所(Noffke et al., 2002; 梅冥相等, 2011)。最后, 除良好的透光性与适宜的粉砂质底质外, 水动力条件对皱饰构造的分布与形态结构亦有重要影响(Mata and Bottjer, 2009), 其中水流需要具有足够的强度以将粉砂岩上的泥质覆盖物冲刷掉, 之后水动力减弱至适当强度时(图7-E), 沉积物颗粒被粘结形成席层(Noffke et al., 2002)。登封馒头组二段沉积于潮间带与潮上带环境, 在适当的水动力强度与沉积速率影响下, 微生物席层会间歇性地被埋藏与迁移, 从而发育多期的胶结作用(Gerdes et al., 1993)。
登封剖面馒头组皱饰构造主要发育在A、C段薄层粉砂岩表面, 粉砂岩中下部未见暴露标志, 推测其形成环境为潮间带, 水体整体较浅(李妲等, 2016), 透光性良好。该时期的潮坪环境中后生动物匮乏, 微生物在该区域受到的环境压力较小, 进而可能在局部形成皱饰构造。A段中皱饰构造纹理较小且薄(图4-C, 4-E), 这可能与潮间带中上部水动力相对较强和透光性相对较弱有关, 并且该段发育了较少的皱饰构造, 其网格状纹理也较小(图4-D, 4-F)。而C段所发育的皱饰构造纹理较大且厚(图4-A, 4-B), 可能是受潮间带上部较强潮汐水动力与良好透光性因素影响。
2.2.2 微生物席裂构造发育的沉积环境 微生物席裂构造的形态多样性可反映出微生物席的厚度和暴露时间长短, 具有很重要的指示意义。馒头组下部C段除广泛发育皱饰构造外, 还发育间歇性暴露标志——席裂构造, 表明微生物席发育于间歇性暴露地表和脱水收缩的潮上带环境(Gerdes et al., 2000; Kovalchuk et al., 2017; 邢智峰等, 2020)(如图8)。由于皱饰构造与席裂构造交互出现, 推测其沉积环境为间歇性暴露的潮上带下部。此外, A段出现席裂构造(图6), 说明此时水体复杂多变, 频繁的海平面变化使得微生物席间歇性暴露于海平面之上。
登封剖面馒头组二段下部皱饰构造和遗迹化石共生现象丰富, 类型多样。对微生物席与后生动物相互影响的研究, 前人认为主要以席足辙迹、席牧食迹与席下矿工所造生物潜穴3种层次的共生类型为主(Buatois et al., 2014)。在借鉴前人研究成果的基础上, 以纵向共生深度为重点, 将研究层位遗迹化石分为3种阶层的共生类型: (1)席上牧食迹与足辙迹; (2)席砂交界处水平漫游迹潜穴; (3)深层泥岩中的生物扰动。
3.1.1 席上牧食迹与足辙迹 登封剖面馒头组二段下部发现的微生物席与遗迹化石共生类型之一为微生物席与足辙迹、牧食迹共生(图9)。微生物席上足辙迹Monomorphichnus henanensis(杨式溥等, 2004)较浅(图9-A, 9-C), 直径一般为毫米级, 推测造迹者为小型节肢动物, 其受自身条件影响, 掘穴能力不高。虽然部分席上足辙迹的存在区域未发现明显的皱饰构造(图9-A, 9-C)作为直观的共生证据, 然而显微镜下悬浮沉积物颗粒的存在亦证明了微生物席的存在(图9-D)。此外, 微生物席基底与节肢动物活动的组合, 可使一些细微的遗迹化石(如Diplichnites)得以保存于较硬的微生物席表面上。这种现象同样出现在幸运阶与寒武系第二统(Seilacher, 2008; Buatois et al., 2014), 这是因为该时期微生物席与浅层扰动沉积物的混合使得底质变硬, 造成沉积物—水界面化学梯度出现巨大差异, 从而可以使细微的节肢动物抓痕与浅层潜穴得到特殊保存(Droser et al., 2002; Seilacher et al., 2005; Sarkar et al., 2016)。所以, 研究层段砂岩表面节肢动物细微抓痕的保存(图9-C), 也印证了微生物席层的存在。
Grazing trails一般被解释为牧食迹, 是造迹生物(蠕虫类)在沉积物中游移、寻找食物时留下的常见觅食构造。该类造迹生物通常在沉积物—水界面之下较浅处进行水平或近水平活动, 是浅层、较安静的低能环境中的造迹者。此类共生表现为遗迹化石发育于微生物席面的上下, 通常紧贴皱饰构造, 为水平方向, 如牧食迹Jinningichnus badaowanensis (杨式溥等, 2004)印痕直径0.15~0.2 cm, 印痕周围粉砂岩层面发育波状皱饰构造(图9-B), 推测其造迹生物紧贴微生物席层面进行觅食或活动, 方向为水平方向。
3.1.2 席砂交界处水平漫游迹 微生物席之下所发育的遗迹化石, 根据保存深浅与形态不同, 可分为紧贴微生物席的水平方向生物潜穴与沉积物底质中的小幅度垂直方向生物潜穴。前者为席砂交界处水平漫游迹(图10), 该类潜穴紧贴微生物席, 大小不一, 直径0.15~0.2 cm(图10-A, 10-B), 最大为0.4 cm(图10-C), 周围皱饰构造发育。此类生物潜穴轮廓清晰, 反映了微生物席对沉积物底质的改造使其具有韧性, 也具有固化沉积物底质的作用。这较为清楚地反映出在微生物席发育过程中此类造迹生物与微生物席共存的关系, 即在微生物席发育过程中, 后生动物紧贴微生物席下部进行觅食掘穴活动, 且并未向上穿透微生物席层。
3.1.3 深层泥岩中的生物扰动 以发育在泥岩中的生物潜穴为主, 上覆黄绿色粉砂岩与皱饰构造(图11-A, 11-C), 潜穴直径0.4~0.5 cm, 填充物为砂(图11-B)。与前一类潜穴相比, 此类潜穴直径明显变大、埋藏较深、数量较多, 在登封馒头组二段频繁出现。与前两类水平共生类型不同, 该类生物潜穴出现了纵向弯曲, 如图11-D中疑似潜穴横截面与斜截面。这表明后生动物不再是单一地在水平方向进行觅食, 而是出现了轻度纵向掘穴行为, 且这种纵向掘穴行为并未对上覆微生物席产生较大影响, 而是向下在泥岩基底中形成生物扰动。此外, 泥岩中出现二叶石迹与节肢动物印痕(图11-E, 11-F), 证明泥岩中较强的生物扰动与三叶虫类节肢动物均存在。
总之, 登封馒头组二段下部识别出的与微生物席共存的遗迹化石特征(图12)如下: (1)遗迹化石保存于研究层段中下部较多, 生物扰动指数1~2, 且自下而上逐渐减弱; (2)微生物席与后生动物共生主要表现为皱饰构造与遗迹化石共存, 可根据后生动物扰动深度分为席上足辙迹和席上牧食迹(共生类型①, 图12-D①)、席砂交界处水平漫游迹(共生类型②, 图12-D②)、泥岩中的生物扰动(共生类型③, 图12-D③)3种皱饰构造—遗迹化石共存类型, 且以后2种类型为主。
登封馒头组二段下部共发现3种类型的遗迹化石与微生物席和皱饰构造共生, 说明此时期微生物群落发育相对繁盛, 微生物席与后生动物出现了较为“和谐”的共生关系。遗迹化石直观反映了后生动物对微生物席产生的浅阶层微弱扰动, 且扰动深度存在差异(图12-D)。登封馒头组二段微生物席—后生动物共生发育过程如图12所示: 微生物丝状体捕捉沉积物颗粒, 形成微生物席层; 后生动物进行微生物席上觅食与席下掘穴, 出现二者共存现象; 出现多期叠覆现象(图12-F)。3种共生类型的深度差异很大程度上取决于后生动物的食物来源, 共生类型①中后生动物或许将微生物丝状体所捕获的悬浮有机物作为食物来源, 而共生类型②、③中后生动物则可能以底质中的沉积物颗粒为食。
研究层段微生物席与皱饰构造广泛发育, 但未发现明显的后生动物穿席或食席所造成的共生遗迹, 故可以推测微生物席上后生动物并未出现食席行为, 微生物席下后生动物也未进行垂直向上的穿席掘穴活动, 仅部分后生动物在泥质基底中出现程度较小的向下垂直掘穴行为。因此, 微生物与后生动物之间并未存在较为严重的相互影响, 而是以一种影响较小、甚至较为“和谐”的方式共存。
埃迪卡拉纪, 底栖生物生存空间较大, 微生物席广泛覆盖于陆架上, 其发育的限制条件更多的来自于环境压力。若排除环境条件限制, 将食物来源作为后生动物的单一影响因素, 那后生动物则更多地进行微生物席上觅食行为(图13)(Seilacher, 2008; Mike et al., 2014), 说明席上营养资源较为充足。此时, 后生动物的扰动为较低水平浅层改造, 因缺乏复杂进食策略的造迹生物, 两者的影响关系较为简单(Buatois and Má ngano, 2003; Buatois et al., 2014)。然而, 这种相互影响的关系是渐进变化的, 埃迪卡拉纪的席底生态在早寒武纪得到延续(Buatois et al., 2014), 甚至在寒武纪之后的一段时期内微生物席的稳定作用依然存在。
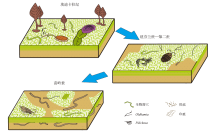 | 图13 埃迪卡拉纪—苗岭世微生物席与后生动物共生生态演化模型(改编自Buatois et al., 2014) 与埃迪卡拉纪相比, 苗岭世的微生物席与后生动物共存模型中保留了席上牧食迹和停息迹, 增加了席上足辙迹(造迹者: 节肢动物)。 此外, 较深层掘穴行为得到了发展, 出现了席下水平潜穴与较深层潜穴Fig.13 Symbiotic ecological evolution model of microbial mat-metazoan during the Ediacaran to Miaolingian (adapted from Buatois et al., 2014) |
显生宙的特征是深层垂向潜穴和广泛的生物扰动导致了混合底质的形成, 大规模增加的物种逐渐改变了生态环境, 并开始与微生物群落及生态环境交互影响。这种微生物席与后生动物相互影响的渐变, 主要体现在纽芬兰世与第二世过渡时期。除与研究层段相似的3类与席共生的遗迹化石(席足辙迹、席牧食迹、席下矿工潜穴)外, Buatois等(2014)在阿根廷西北部Puncoviscana组同样识别出与微生物席相关的微小分支潜穴, 表明生物扰动在寒武纪得到了发展。中国同时期的沉积物中也存在一致的证据(Dornbos et al., 2004; Buatois and Má ngano, 2011; Buatois et al., 2014), 如Dornbos等(2004)在中国云南纽芬兰统梅树村组识别出的皱饰构造以及席上抓痕与席下生物潜穴, 证明微生物席和后生动物的相互影响与新元古代模式类似, 也表明在埃迪卡拉纪到寒武纪过渡时期, 生物扰动强度在时间和空间上具有变化。美国大盆地下寒武统Harkless组的遗迹化石Helminthopsis分别存在于皱饰构造表面和之下的薄层底质中, 以水平方式保存(Bailey et al., 2006)。上述关于纽芬兰统的研究和登封馒头组二段中所识别出的与席共生牧食迹Jinningichnus badaowanensis一致(图9-B), 生物扰动大部分依然停留在微生物席之上。基于寒武纪混合底质发展的时空特点, 即典型的元古代软底和典型的显生宙型软底同时存在于寒武纪的大部分时间内, 底质的延续有助于部分“机会主义”后生动物在整个寒武纪、甚至之后的一段时间里延续具元古代特征的进食方式。这或许可以说明, 登封苗岭世后生动物仍延续了埃迪卡拉纪的席底行为, 其作为“机会主义”生物延续, 适应了显生宙的混合底质生态环境。
进入寒武纪第二世, 潮上带与潮间带中上部依然普遍发育微生物席(Buatois and Má ngano, 2012), 而后生动物开始对微生物席进行微弱的浅层改造。如河南寒武系第三阶出现的牧食迹与觅食迹, 表明造迹生物通常并不能穿透沉积物, 仅对沉积物产生微弱的浅层改造。此外, 在伊朗中部第二统顶部Lalun组发现了与微生物席相关的沉积构造和浅层遗迹化石(如Helminthopsis, Planolites)共存(Bayet-Goll et al., 2021), 其同发现于寒武系第二统的分支、网状潜穴一样(Seilacher et al., 2005; Buatois et al., 2014)(图13), 浅层扰动一般只存在于岩层界面, 未对微生物席主导的环境造成破坏。
Dornbos等(2005)在加拿大中寒武统Burgess页岩中发现同时适应元古代软底与显生宙软底的后生动物, 这与登封苗岭世同时存在多种类型后生动物扰动和微生物席共存现象一致。登封苗岭组不仅保存了具有埃迪卡拉纪特征的后生动物与微生物席共存现象, 同时出现了节肢动物抓痕与泥岩中生物扰动和微生物席共存的现象。甚至到寒武纪晚期, 微生物席仍与软体动物遗迹(Climactichnites)、休息迹(Musculopodus)和足辙迹(Protichites)共生(Hagadorn et al., 2002), 尤其是在微生物席发育的潮坪环境中, 发育深阶层的生物潜穴Skolithos(Buatois and Má ngano, 2012)。
上述实例揭示出在寒武纪的大部分时间里, 微生物席与生物扰动持续共存, 部分后生动物将与埃迪卡拉纪相关的进食策略保留至寒武纪中晚期。同时, 节肢动物抓痕与泥岩中生物潜穴的出现, 说明与微生物席相关的具显生宙特征的生物扰动已经出现并逐渐发展。
进一步研究发现, 上述和谐的共生关系可能是在环境因素影响下微生物与后生动物竞争与妥协的结果。虽然寒武纪生物大爆发后, 混合底质的发展使得微生物群落更易聚集在受生物扰动限制以外的零星地区附近, 但皱饰构造却能在生物扰动水平整体较低的环境中形成, 且生物扰动可以微弱存在。在此环境压力下, 豫西馒头组二段下部皱饰构造表现出微生物席对于整体环境条件的选择, 并持续至寒武纪中期, 即皱饰构造只在环境应激的间隔期形成, 生物扰动程度较小。
微生物席对于后生动物的影响是利弊皆有的。一方面微生物群落可以提供大量有机物并创造一个富氧区域(Gingras et al., 2011), 部分具埃迪卡拉特征的生物将席下有机碳作为重要的营养来源(Sarkar et al., 2016), 并可能已经适应了席下的特殊环境。另一方面, 这些有机物还促进了硫酸盐还原效率的提高, 硫酸盐还原会产生有毒的硫化氢与低氧条件(Seilacher et al., 2005), 从而限制了后生动物的居住(朱茂旭等, 2011; 赵相宽等, 2018)。此外, 形成微生物席的不同微生物群落会导致沉积物上层产生化学梯度的巨大差异(Bosak et al., 2012), 而那些保留埃迪卡拉特征的部分后生动物逐渐适应了氧含量波动与硫化环境, 并将这片区域作为一个独特的生态场所。因此, 在小区域的斑块环境中出现了微生物席与后生动物的共存的现象。
在微生物群落发育受限的基础上, 结合微生物席上较浅的细小抓痕(图9-A), 认为此时后生动物及席下矿工具有的掘穴能力不高(Sarkar et al., 2016), 部分后生动物只能进行席上觅食或在席下进行较浅的水平方向的觅食。此时, 后生动物似乎并不能穿透由胞外聚合物质(Extracellular Polymeric Substances, EPS)所粘合沉积颗粒的坚韧微生物席(钟怡江等, 2022), 席砂交界处水平潜穴(图10)证明了此观点。由于经历此环境筛选后的后生动物数量较少, 没有相对紧张的生存环境, 宽松的环境压力允许后生动物沿着微生物席或沉积物表面觅食(Fedonkin et al., 2007), 且水平分布的牧食迹表明潮间环境有悬浮的有机颗粒或及微生物, 造迹生物无需更深掘穴(李妲等, 2016), 因此, 此时的后生动物可能更多地采用较为被动的进食策略, 并未积极改变生存环境, 双方表现出较为和谐的共存关系。
1)豫西登封寒武系馒头组二段下部发育皱饰构造与席裂2种微生物成因沉积构造, 形成环境为潮间带中部到潮上带下部。寒武纪潮间带环境中生物的种类和数量较少, 中上部良好的透光性、强度适中的水动力以及粉砂岩底质, 满足了微生物席发育的条件, 受不同水动力强度影响, 皱饰构造形态多样。潮上带下部间歇性地暴露, 为微生物席裂构造发育的控制因素。
2)建立了微生物席—后生动物共生发育模型。与皱饰构造共存的遗迹化石可划分为3类: 皱饰构造层面发育的节肢动物抓痕(Monomorphichnus henanensis)与牧食迹(Jinningichnus badaowanensis), 皱饰构造层面之下发育的漫游迹(Planolites moutonus), 皱饰构造下部泥岩中发育的强生物扰动。研究区以后两种共生为主。
3)进入中寒武世, 混合底质环境继续发展, 受生物扰动影响的微生物群落被限制在强烈生物扰动区域外的潮坪环境中, 后生动物的匮乏使得该环境中微生物席能得以延续, 并且少数“机会生物”以及三叶虫类节肢动物已经向潮坪环境中拓展了生态空间。
4)建立了寒武系苗岭统馒头组微生物席与后生动物共生生态演化模型。该时期与微生物席共生的生物, 除了一些低等软体动物之外, 还有三叶虫类节肢动物向潮坪区域扩张。后生动物类型较埃迪卡拉纪明显增加, 生物扰动程度也进一步的增强, 但由于受到微生物席的限制, 所以大部分后生动物都在微生物席表面觅食或作为席下矿工觅食。
(责任编辑 张西娟; 英文审校 刘贺娟)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|